原子価とは価標(棒線)の本数のことです。この意味について詳しく解説したうえで代表的な原子の原子価の一覧を紹介します。また、紛らわしい価電子との違いについても解説します。担当は、灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師です。
原子価とは
原子価とは、注目した原子から出ている価標(棒線)の本数のことです。
では、価標とは何だったのか、価電子や不対電子などとの違いについて説明していきます。
価電子数と原子価の違い
価電子とは最外殻に存在する電子の数のことです。
価電子数が4個までであれば、原則すべて不対電子として存在するため価電子数と不対電子の数が一致し、他原子と結合した際、価標の数とも一致します。
例:炭素

価電子数が4つなので、すべて不対電子となります。
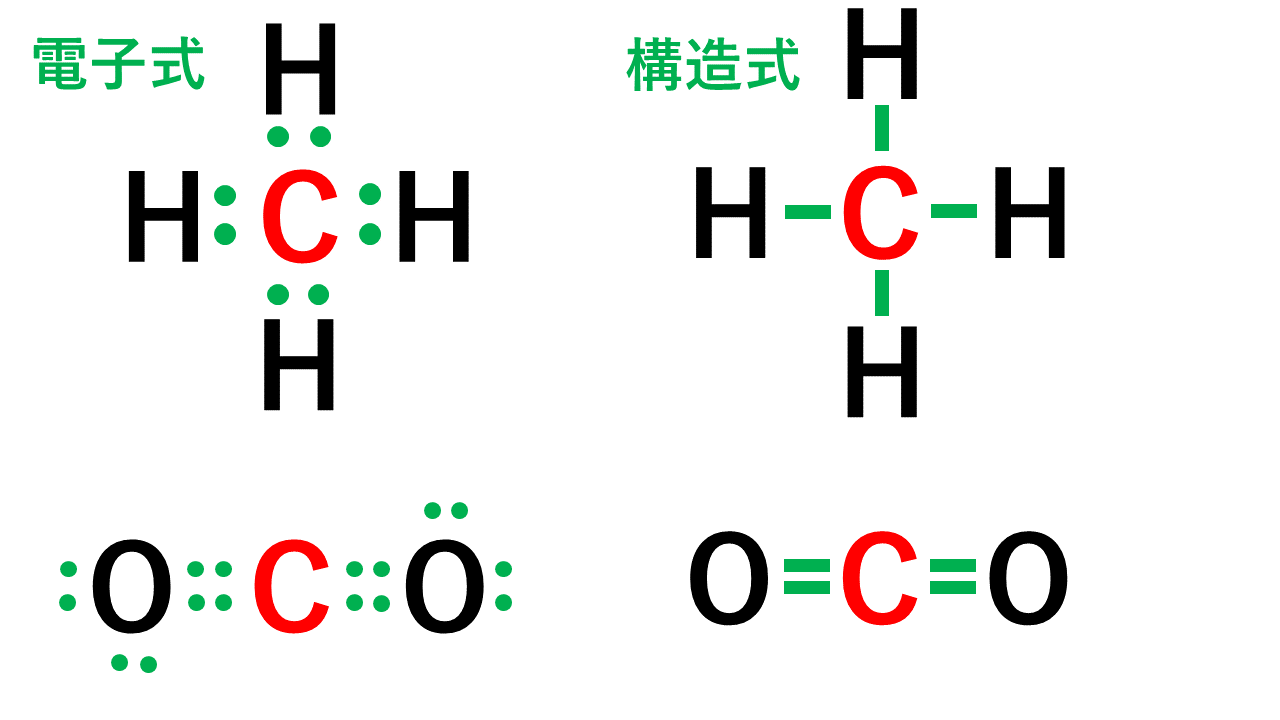
例えば、メタンCH4の場合、不対電子4つと水素が共有結合し、4本の共有結合が生じます。炭素原子Cからは、価標(棒線)が4本出ています。
二酸化炭素CO2の場合、二重結合となりますが、同様に炭素原子Cからは、価標(棒線)が4本出ています。
よって、Cの原子価は4です。
例:窒素

価電子数5つのうち、3つが不対電子となります。
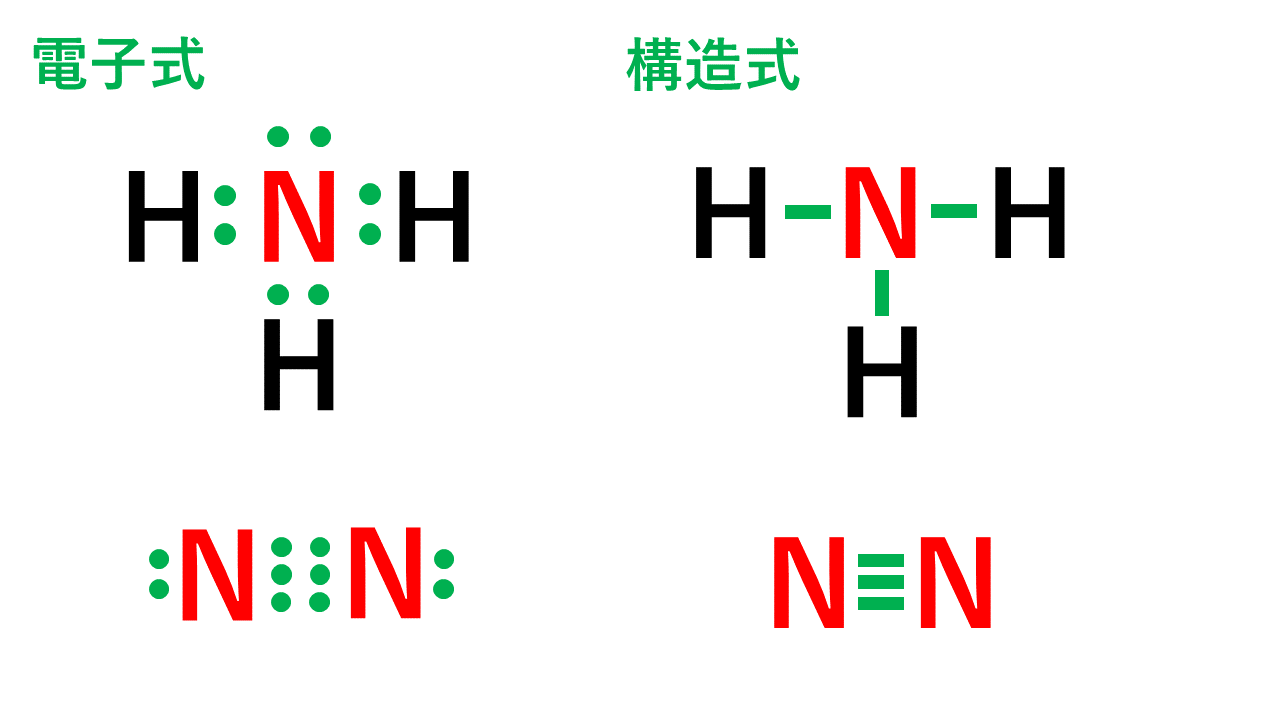
例えば、アンモニアNH3の場合、不対電子3つと水素が共有結合し、3本の共有結合が生じます。窒素原子Nからは、価標(棒線)が3本出ています。
窒素分子N2の場合、三重結合となりますが、同様に窒素原子Nからは、価標(棒線)が3本出ています。
よって、Nの原子価は3です。
入試で覚えておくべき原子価の一覧
この原子価という考え方は、有機化学分野の構造式を考える際に有効なので、有機化学でよく出る原子の原子価を一覧で紹介します。
| 水素H | 1 |
|---|---|
| 炭素C | 4 |
| 窒素N | 3 |
| 酸素O | 2 |
| フッ素F | 1 |
| 硫黄S | 2 |
| 塩素Cl | 1 |
| 臭素Br | 1 |
| ヨウ素I | 1 |
以上より、
原子価、つまり価標の本数というのは、原子状態での不対電子の数と一致するということです。
まとめ
灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師より、原子価の意味と一覧、紛らわしい価電子や不対電子、価標との違いまで詳しく解説しました。しっかりと覚えておきましょう。