液体より固体のほうが体積が小さいはずなのに、水より氷の体積が大きく(密度が小さく)なる理由について、高校化学基礎レベルで詳しく解説します。解説担当は、灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師です。
粒子の熱運動
物質を構成している粒子は、その温度に応じた運動の激しさをもち、絶えず活発な運動をくり返しています。このような粒子の運動を熱運動といいます。
- 粒子間に働く引力を振り切って自由に動くようになった状態が気体です。熱運動が最も激しく、体積は最も大きくなります。
- 温度が下がり、粒子同士が相互に位置を変える程度に動ける状態が液体です。そのため、熱運動は気体に比べるとグッと小さくなり、体積は小さくなります。
- さらに温度が下がり、相互に位置が固定され、振動や回転運動のみとなった状態が固体です。熱運動が液体に比べても小さくなり、体積は最も小さくなります。
これが通常の物質です。
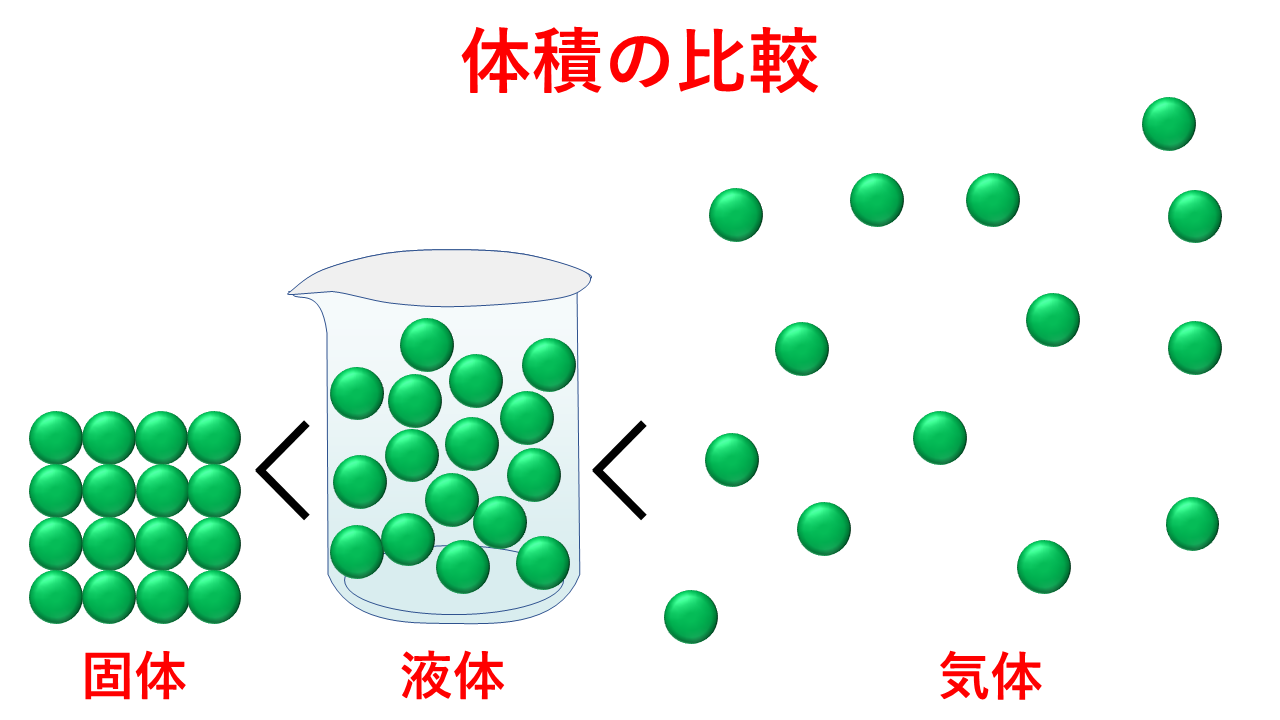
しかし、例外的に水だけは固体(氷)が体積最小とはなりません。
水より氷の体積が大きい(密度が小さい)理由
上で見たように、通常の物質では、融解(固体から液体への状態変化)に際して、粒子1個あたりの運動空間が広がって体積が増加(密度が減少)します。しかし、水は4℃で体積最小(最大密度)を示します。
その理由について解説していきます。
前提として、氷は1個の水分子と他の4個の水分子との水素結合による正四面体構造をとっています。
左は水(液体)、右は氷(固体)の結合状態のイメージです。

出典:http://sciencenet.seesaa.net/article/431177317.html?1452003018
① 融解の際、水素結合の一部が切断され、結晶中のすき間を埋めるように水分子が入り込みます。その際、急激に体積が減少(密度が増加)します。
②
(ⅰ) 0℃を過ぎても液体の水の中には部分的な氷の構造が残っているため、温度を上げるとこの構造がこわれて体積はさらに減少していきます。
(ⅱ) 温度が上がると水分子の熱運動が激しくなり、体積は増加(密度は減少)していきます。
4℃以下では(ⅰ)の効果>(ⅱ)の効果のため体積は減少していき、4℃以上になると(ⅰ)の効果<(ⅱ)の効果となるため体積は増加していきます。
そのため、4℃で体積最小(密度最大)となります。
まとめ
灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師より、通常液体より固体のほうが体積が小さいはずなのに、水より氷の体積が大きく(密度が小さく)なる理由について詳しく解説しました。しっかりと覚えておきましょう。


