配位結合の仕組みと、配位結合と共有結合の違い、構造式中の矢印の意味、錯イオンの形成の仕組みなどをアンモニアなどの具体例をもとに解説します。解説担当は、灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師です。
配位結合とは
一方の原子からの非共有電子対が,他方の原子からはそれを受け入れる空軌道が提供されてできる共有結合を配位結合といいます。
配位結合は結合のできるしくみが異なるだけで,できた結合はふつうの共有結合とは全く変わりません。
配位結合と共有結合の違い
共有結合は1:1で電子を共有する仕組みの結合で、配位結合は2:0で電子を共有する仕組みの結合です。結合した後は見分けがつきません。
配位結合の具体例と構造式、矢印の意味
アンモニウムイオン
アンモニア中の窒素原子の非共有電子対を、電子をもたない水素イオンに一方的に与えることで結合が形成されます。
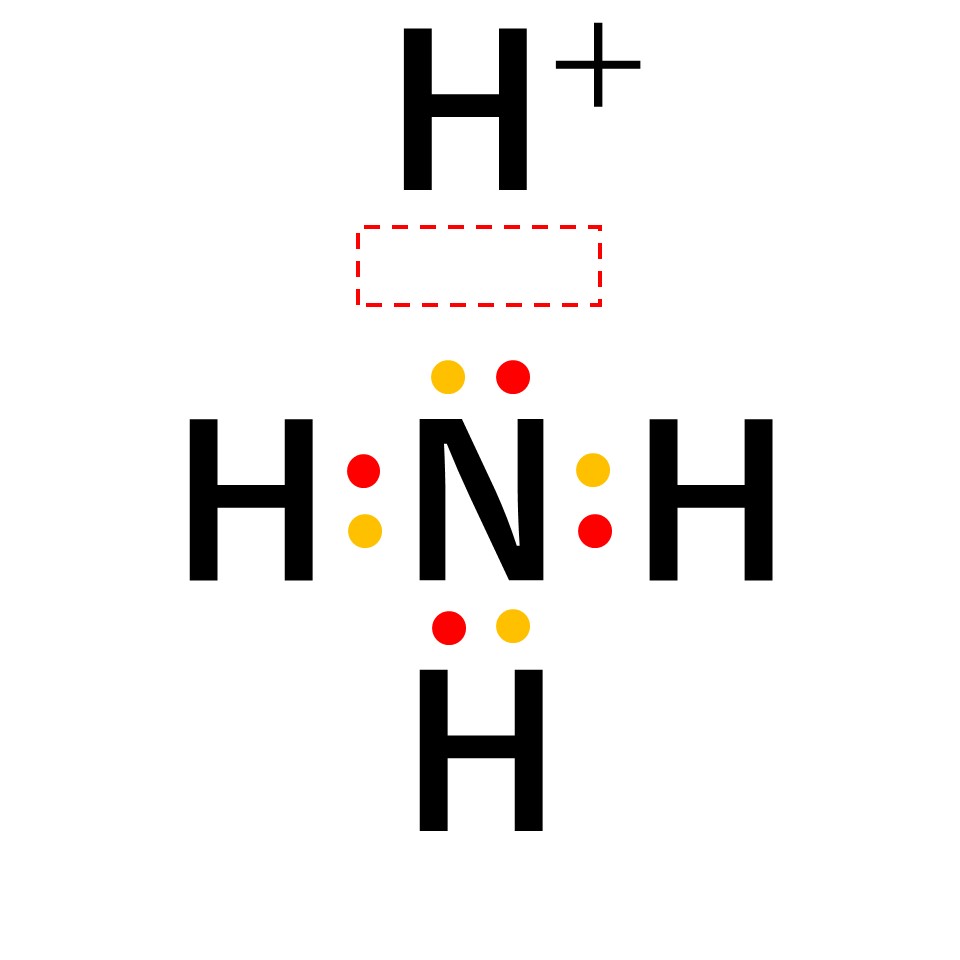
アンモニウムイオンは、±0であるアンモニア分子と+1の水素イオンが配位結合しているため、全体で+1になります。結合後は共有結合でくっついた水素なのか配位結合でくっついた水素なのかの見分けはつかないため、以下のように電子式はトータルで「+」と書きます。
構造式では、配位結合の部分を「矢印」で表すこともあります。この場合、矢印の向きは電子を与える方向に書きます。しかし、矢印で必ず書かなければならないというわけではなく、価標(棒線)で書いても構いません。ただし、矢印で書いた方が配位結合が存在することが示せるというメリットがあるため、こういった記述が存在します。
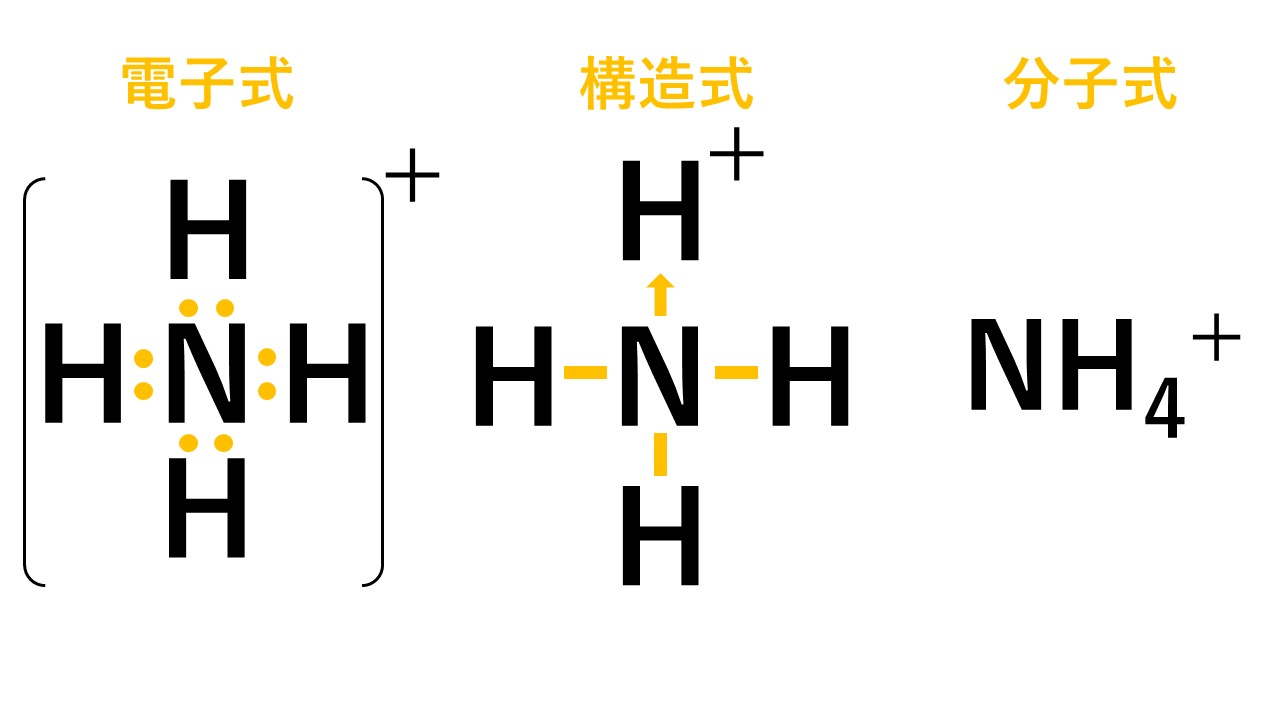
まとめ
灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師より配位結合と共有結合の違い、矢印の意味、錯イオンの形成の仕組みなどをアンモニアなどの具体例をもとに図(アニメーション)で解説しました。しっかりと覚えておきましょう。


