共有結合の結晶であり同素体であるダイヤモンドと黒鉛は、その構造の違いから機械的性質、電気伝導性が全く異なります。その構造の違いが生じる原因から詳しく解説します。解説担当は、灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師です。
C(炭素)の同素体かつ共有結合の結晶(共有結晶)
ダイヤモンドも黒鉛もともにC(炭素)の同素体であり、どちらも共有結合が際限なく結合し続けて形成された共有結合の結晶(共有結晶)です。
ダイヤモンドと黒鉛の構造
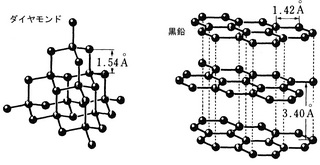
同素体であるダイヤモンドと黒鉛は構造が異なります。
炭素Cは原子番号が6番なのでK殻に2個の電子が入り、L殻(最外殻)に4個の電子をもっています。
そして原子状態では4個の電子すべてが不対電子ですが、結合に使われる価電子の数が違います。
ダイヤモンドの場合、上の図のように炭素Cの価電子4個をすべて結合に使います。
このため、4組の共有電子対はマイナスの性質をもった電子なので、静電気力により反発しており、4本の結合すべてを最大限に遠ざけると上の図のように正四面体の頂点の方向に配置され、立体的で巨大な構造をとることになります。
これに対し、黒鉛の場合、炭素Cの価電子4個のうち3個を結合に使うため、3組の共有電子対はマイナスの性質をもった電子なので、静電気力により反発しており、3本の結合すべてを最大限に遠ざけると上の図のように正三角形の頂点の方向に配置され、黒鉛は網目状の平面構造を作り、その平面同士が非常に弱い力であるファンデルワールス力によって結合し形成されています。
ダイヤモンドと黒鉛の機械的性質
ダイヤモンドは立体的に共有結合しており、結合自体が非常に強いため極めて硬いです。

それに対し、黒鉛は非常に強い共有結合で平面状につながっており、平面どうしは弱いファンデルワールス力でつながっているため、薄くはがれやすくやわらかいという性質があります。

ダイヤモンドと黒鉛の電気伝導性
ダイヤモンドは価電子4個すべてを結合に使っているため、電気伝導性はありません。
これに対し、黒鉛は価電子4個のうち3個を結合に使い、残り1個の電子は結晶中を自由に移動できるため、電気伝導性があります。
まとめ
灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師より、共有結合の結晶であり同素体であるダイヤモンドと黒鉛の違いの原因について詳しく解説しました。しっかりと覚えておきましょう。

