溶液、溶媒、溶質の違い、モル濃度と密度、質量パーセント濃度の違い、公式、求め方、関係性についてわかりやすく解説します。解説担当は、灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師です。
溶解・溶質・溶媒・溶液とは
溶解とは、液体中に他の物質が拡散して均一な液体となる現象です。
溶質とは、溶け込んだ物質であり、溶媒とはその溶質を溶かす液体であり、溶液とは溶解によって生じた均一な液体混合物です。
例えば、食塩水を例にとると、食塩が溶質、水が溶媒、食塩水自体が溶液ということです。
ちなみに、溶質は固体しかないと思われがちですが,液体、気体の場合もあります。
液体の溶質だと、例えばエタノールです。
液体のエタノールを水に溶かしてエタノール水溶液ができます。
気体の溶質だと、炭酸水などがありますね。気体の二酸化炭素を水に溶かして炭酸水溶液ができます。
モル濃度とは
モル濃度とは、溶質の物質量[mol]を溶液の体積[L]で割ったものです。
モルとは個数のことでした。(1mol = 6.0×1023個)
公式です。
$$モル濃度[mоl/L] = \frac{溶質の物質量[mоl]}{溶液の体積[L]}$$
$$溶質の物質量[mоl] = モル濃度[mоl/L]×溶液の体積[L]$$
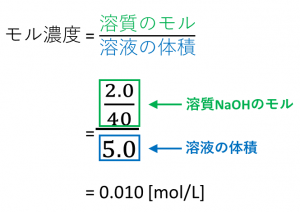
【例題1】 NaOH = 40のとき、NaOH2.0gを水に溶かして全体で2.0Lとしたときのモル濃度を求めよ。
【解答1】
【例題2】0.05mol/Lの水酸化カリウム水溶液が20mLある。この溶液中に含まれる水酸化カリウムは何molか。
【解答2】

質量パーセント濃度とは
質量パーセント濃度とは、溶質の質量[g]を溶液全体の質量[g]で割って100をかけたものです。
以下公式です。
$$質量パーセント濃度[%] = \frac{溶質の質量[g]}{溶液の質量[g]}×100$$
密度とは
密度とは、溶液全体の質量[g]を溶液全体の体積[L]で割ったものです。
以下公式です。
$$密度[g/cm^3] = \frac{溶液全体の質量[g]}{溶液全体の体積[cm^3]}$$
質量モル濃度とは
おまけです。質量モル濃度とは、溶質の物質量[mol]を溶媒の質量[kg]で割ったものです。
公式です。
$$質量モル濃度[mоl/kg] = \frac{溶質の物質量[mоl]}{溶媒の質量[kg]}$$
モル濃度との違いは分母です。
モル濃度では、溶液の体積[L]だったのに対し、質量モル濃度では溶媒の質量[kg]です。
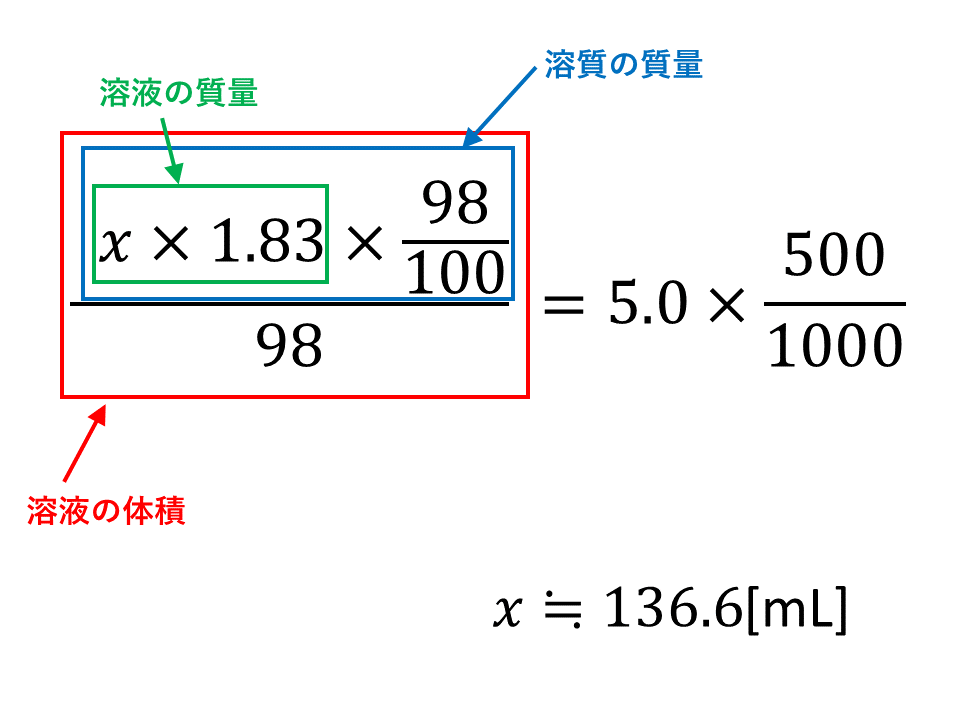
頻出の練習問題
質量パーセント濃度が98%の濃硫酸があり、その密度は25℃で1.83g/cm3である。この濃硫酸を水で薄めて、5.0mol/Lの希硫酸500mLをつくるには、何mLの濃硫酸が必要か。
まとめ
灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師よりモル濃度、質量パーセント濃度、密度について解説を行いました。しっかりと覚えておきましょう。