再結晶とは、溶解度の差を利用して固体どうしの混合物を分離する方法です。計算問題でも頻出の「再結晶法」の原理と方法を、硝酸カリウムと塩化ナトリウムを例に解説します。解説担当は、灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師です。
再結晶とは
再結晶とは、溶解度の差を利用して固体どうしの混合物を分離する方法です。
物質の溶解度は温度により変わるため、このときの溶解度の差を利用して物質を分離します。
【頻出の具体例】KNO3とNaClの混合物の分離
硝酸カリウムKNO3は温度による溶解度の差が非常に大きいため、高温のKNO3飽和水溶液を冷却すると、多くの固体が析出します。
それに対し、塩化ナトリウムNaClは温度による溶解度の差が小さいため、同じように高温のNaCl飽和水溶液を冷却してもほとんどNaClの固体は析出しません。
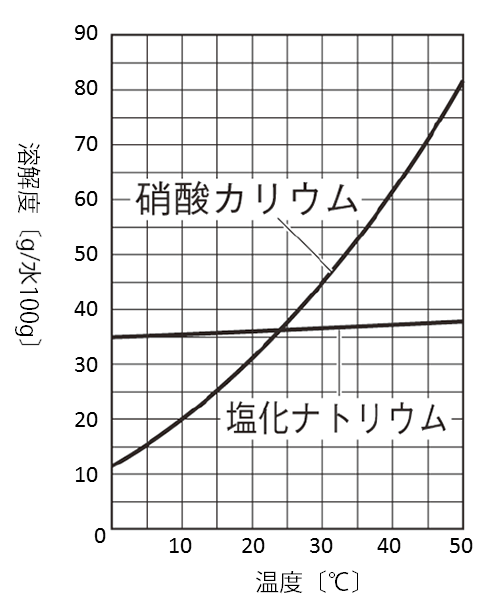
そのため、KNO3とNaClの混合物を高温で高濃度の水溶液にした後に冷却すると、純粋なKNO3を固体として分離する事ができます。
まとめ
灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師より受験生が迷う分離法より再結晶法の原理や方法の解説を行いました。しっかりと覚えておきましょう。


