極性分子か無極性分子かの判断は、結合自体の極性に加え、分子の形を判断しなければいけません。なぜ分子が正四面体、三角錐、折れ線、直線、正三角形になるのかを丁寧に解説します。解説担当は、灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師です。
目次
結合の極性と電気陰性度
同じ種類の原子間に働く共有結合では、電荷の偏りは生じませんが、異なる種類の原子間に働く共有結合の場合、電気陰性度の違いに基づいた電荷の偏りが生じます。つまり、電気陰性度が大きい原子の方に共有電子対が引き寄せられ、その原子がマイナスに帯電し、もう一方の原子はプラスに帯電します。
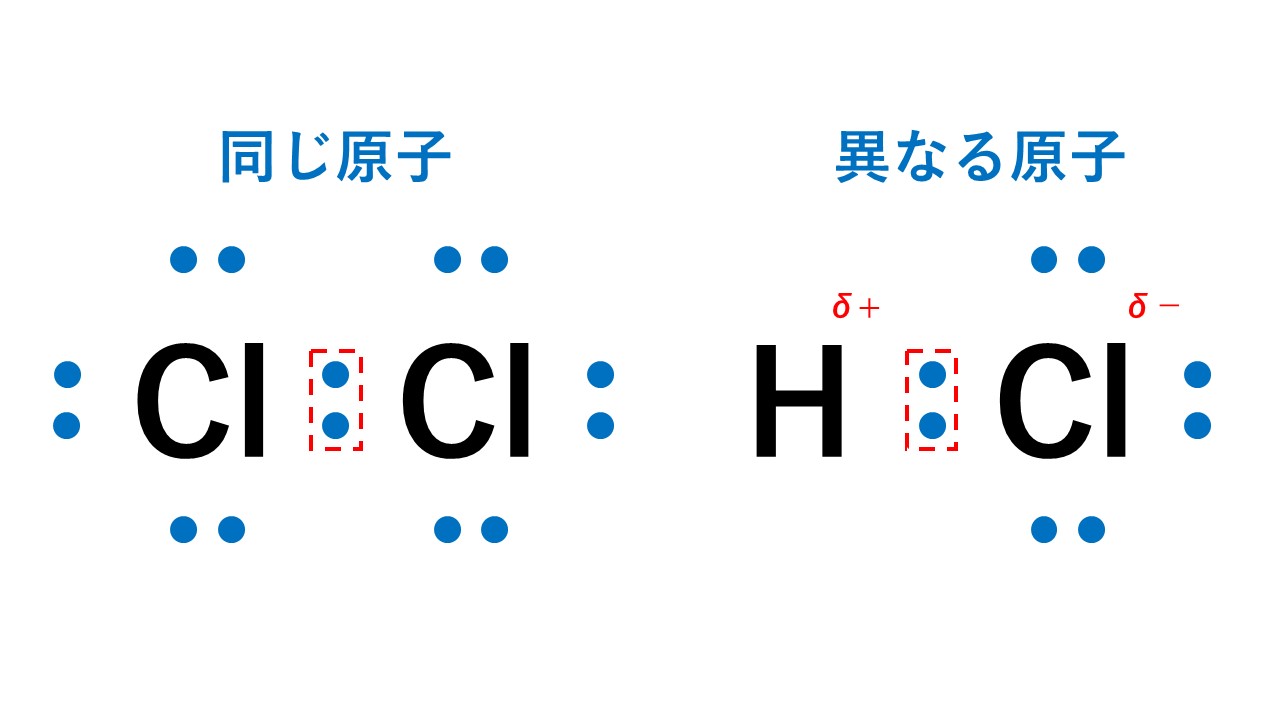
例えば塩化水素では、電気陰性度が大きいCl原子に共有電子対が引き寄せられ、Cl原子がδ-に帯電し、H原子はδ+に帯電します。
電気陰性度の差によって生じる電荷の偏りを極性といい、極性を持つ分子を極性分子といいます。
一方、塩素分子Cl2では、同じ種類の原子が結合しているため、共有電子対は偏りません。
このように極性を持たない分子を無極性分子といいます。
分子の形の考え方
結合に極性があったとしても、分子の形の影響で全体に極性があるかどうかが変わります。ただの丸暗記ではなく、理屈を理解しておき、自分が知らない分子の形も考えられるようにしましょう。
STEP2.正四面体ベース、正三角形ベース、直線ベースのどれかを考える
STEP3.分子の形を決定
正四面体ベースの分子の形
共有電子対、非共有電子対を問わず、電子対が4セットある場合は正四面体ベースとなります。
4組の電子対はマイナスの性質をもった電子なので、クーロン力(静電気力)により反発しており、4組の電子対すべてを最大限に遠ざけると以下の図のように正四面体の頂点の方向に配置されることになります。
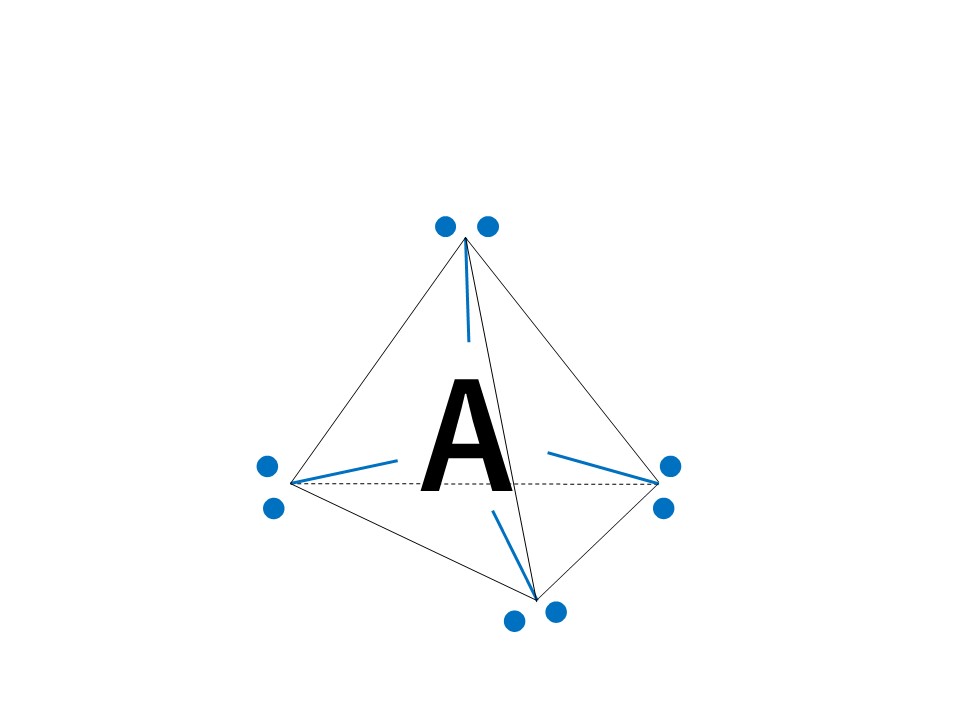
正四面体形
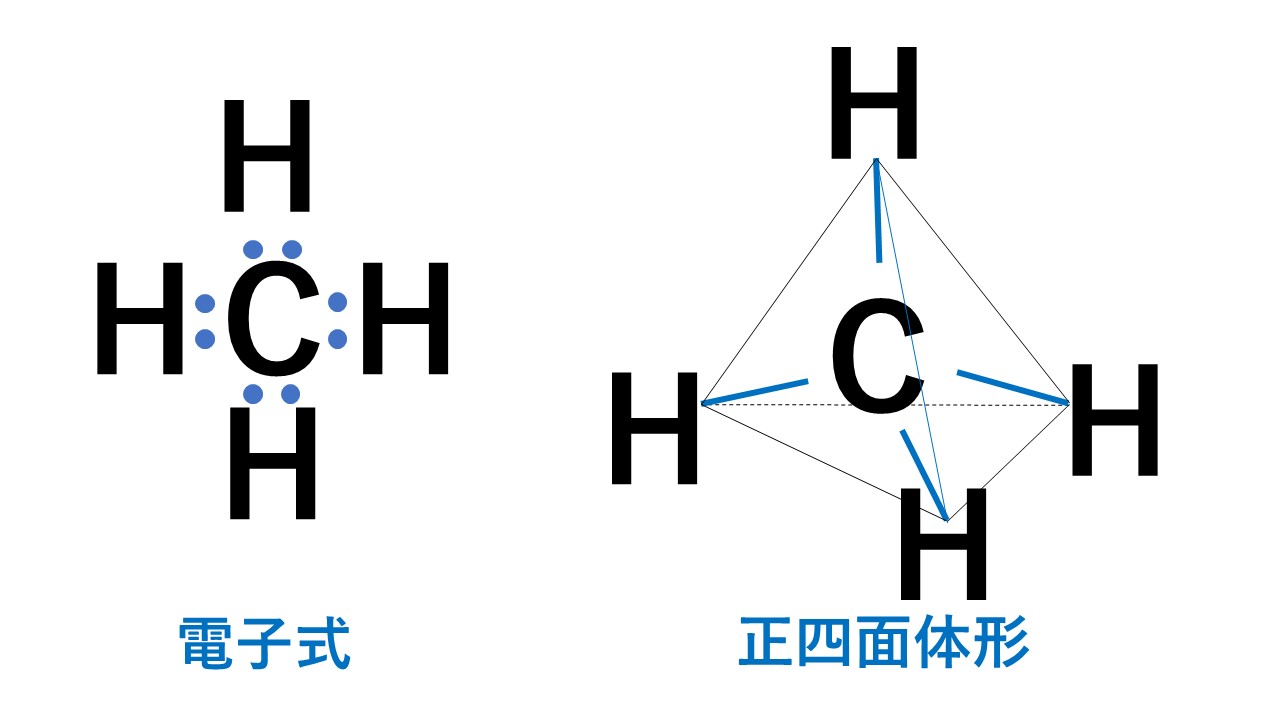
代表例はメタンCH4です。
4組の電子対はすべて水素原子との間の共有電子対です。そのため正四面体形となります。
三角錐形
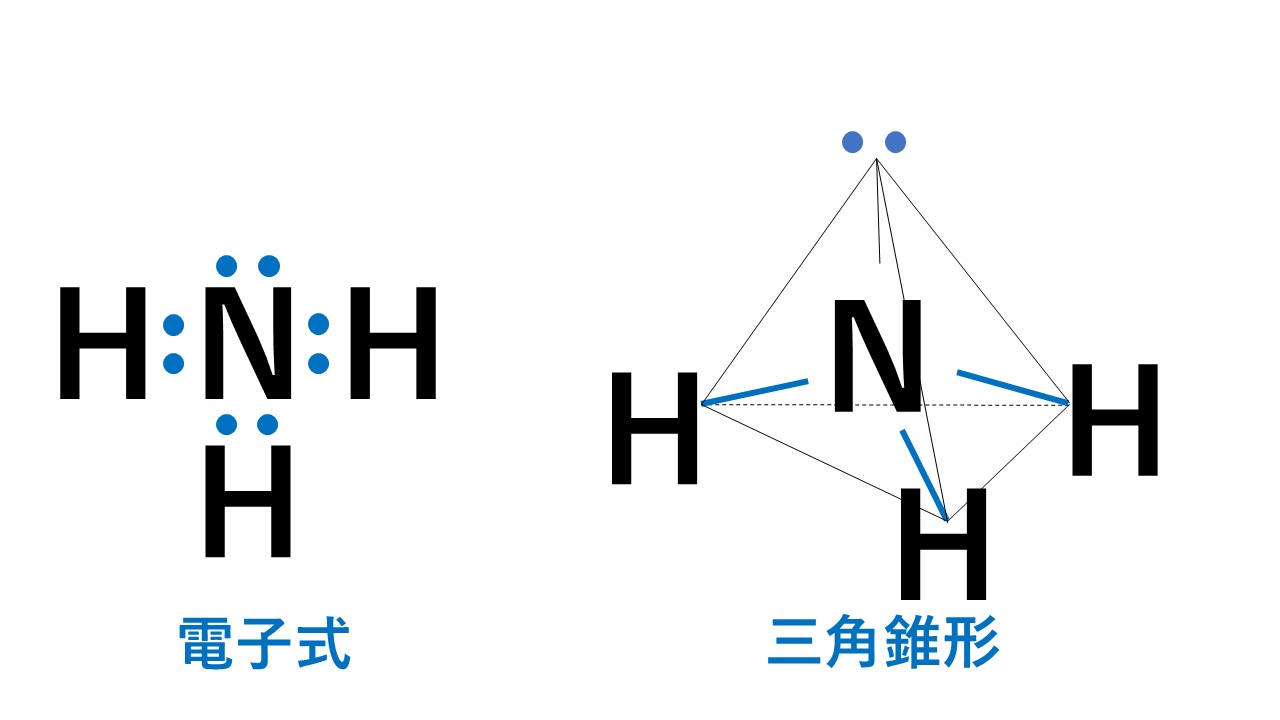
代表例はアンモニアNH3です。
4組の電子対のうち3組が水素原子との間の共有電子対です。そのため三角錐形となります。
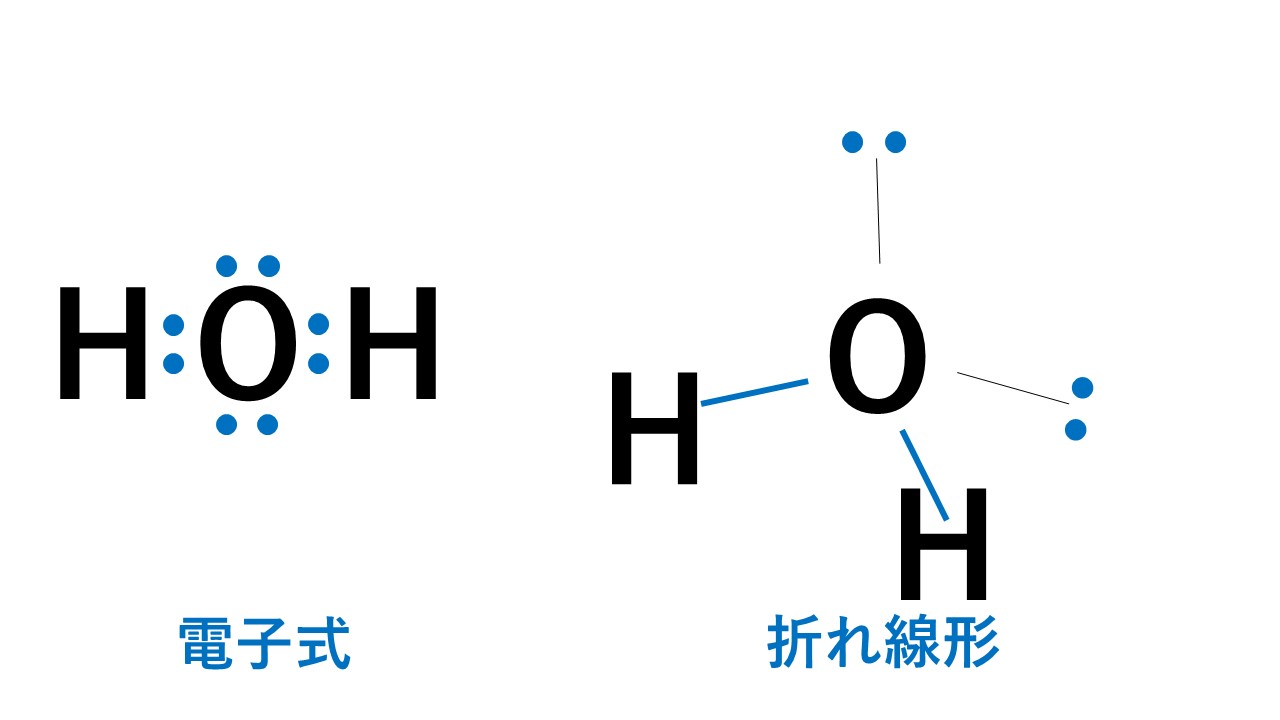
折れ線形
代表例は水H2Oです。
4組の電子対のうち2組が水素原子との間の共有電子対です。そのため折れ線形となります。
正三角形ベースの分子の形
共有電子対、非共有電子対を問わず、電子対が3セットある場合は正三角形ベースとなります。
3組の電子対はマイナスの性質をもった電子なので、クーロン力(静電気力)により反発しており、3組の電子対すべてを最大限に遠ざけると正三角形の頂点の方向に配置されることになります。
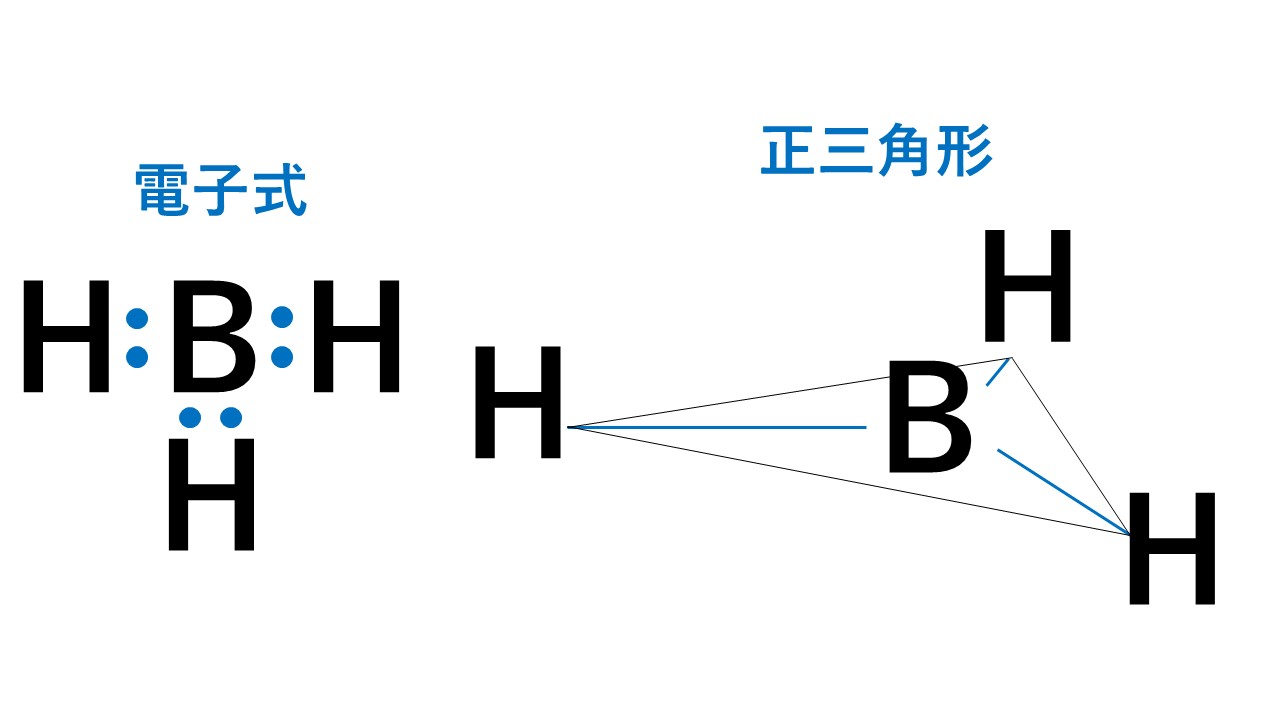
正三角形
代表例は水素化ホウ素BH3です。
3組の電子対はすべて水素原子Hとの間の共有電子対です。そのため、右図のように水素原子Hを結ぶと正三角形となります。
直線ベースの分子の形
二原子分子の場合
水素H2,窒素N2,フッ化水素HFなどの二原子分子の場合は直線形です。
三原子以上の分子で直線形
共有電子対が2セットある場合は直線形となります。
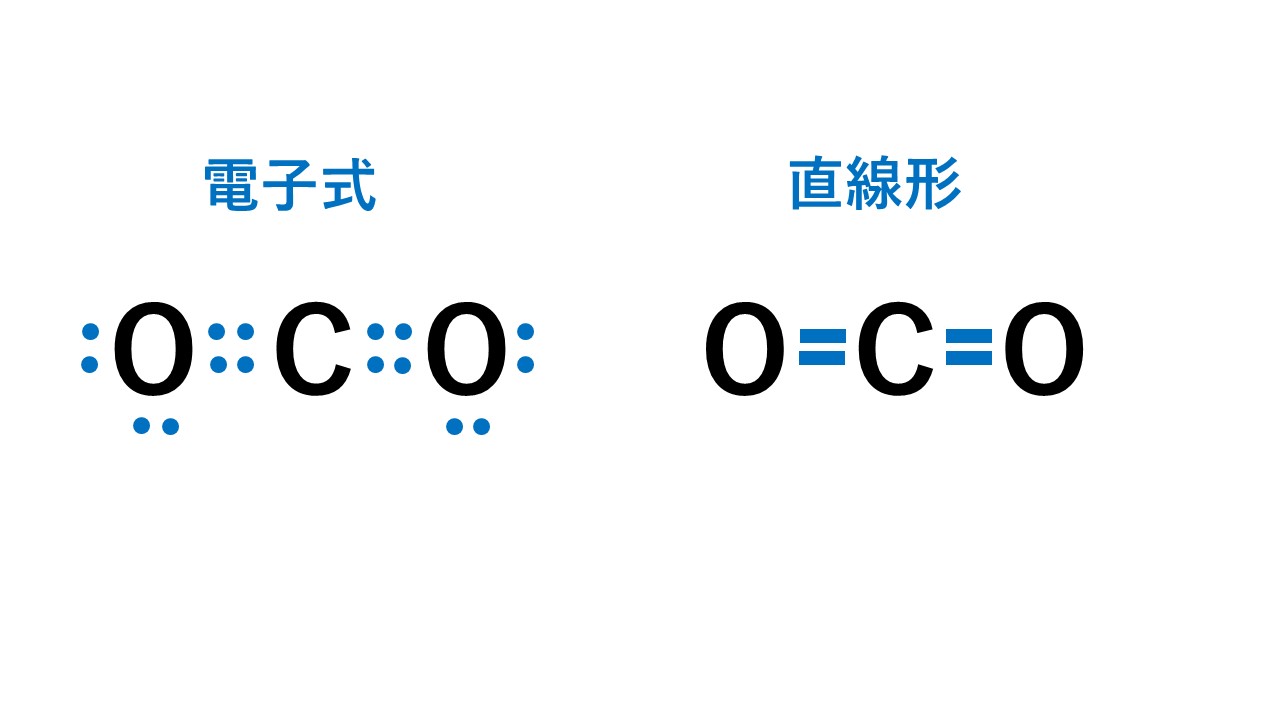
代表例は二酸化炭素CO2です。
2組の二重結合はマイナスの性質をもった電子なので、クーロン力(静電気力)により反発しており、2組の二重結合を最大限に遠ざけると以下の図のようにCを中心に対称となる位置にOが配置されることになります。
そのため、二酸化炭素は直線形となります。
極性分子と無極性分子の判断の仕方
電気陰性度の異なる原子が共有結合すると,電気陰性度の大きい原子のほうが共有電子対を引きつけるため,原子間に電気的偏りを生じます。この電気的偏りを結合の極性といいます。
結合に極性があっても,その極性が互いに打ち消しあって,分子全体としては無極性分子になることもあります。
極性分子
アンモニアNH3
アンモニアでは、N原子のほうがH原子より電気陰性度が高いため、N原子が共有電子対を引き寄せ、負に帯電し、H原子が正に帯電します。また、形は三角錐なので、負電荷の重心の位置はN原子の位置のままとなり、正電荷の重心は底面の三角形の重心の位置となるため、重心位置が一致せず極性が打ち消されません。
水H2O
水では、O原子のほうがH原子より電気陰性度が高いため、O原子が共有電子対を引き寄せ、負に帯電し、H原子が正に帯電します。また、形は折れ線なので、負電荷の重心の位置はO原子の位置のままとなり、正電荷の重心は両端の真ん中の位置となるため、重心位置が一致せず極性が打ち消されません。
塩化水素HCl
塩化水素では、Cl原子のほうがH原子より電気陰性度が高いため、Cl原子が共有電子対を引き寄せ、負に帯電し、H原子が正に帯電します。また、形は直線なので、負電荷の重心の位置はCl原子の位置のままとなり、正電荷の重心の位置はH原子の位置となるため、重心位置が一致せず極性が打ち消されません。
無極性分子
メタンCH4
メタンでは、C原子のほうがH原子より電気陰性度が高いため、C原子が共有電子対を引き寄せ、負に帯電し、H原子が正に帯電します。また、形は正四面体なので、負電荷の重心の位置はC原子の位置のままとなり、正電荷の重心は四面体の重心位置であるC原子の位置と一致するため、極性が打ち消されます。
水素化ホウ素BH3
水素化ホウ素では、B原子のほうがH原子より電気陰性度が高いため、B原子が共有電子対を引き寄せ、負に帯電し、H原子が正に帯電します。また、形は正三角形なので、負電荷の重心の位置はB原子の位置のままとなり、正電荷の重心は正三角形の重心位置であるB原子の位置と一致するため、極性が打ち消されます。
フッ素F2
フッ素のように、同じ種類の元素のみからなる分子は電気陰性度に差がないため、極性がそもそもありません。
極性引力とは
極性分子どうしには極性引力という力が働き、引き付けあっています。
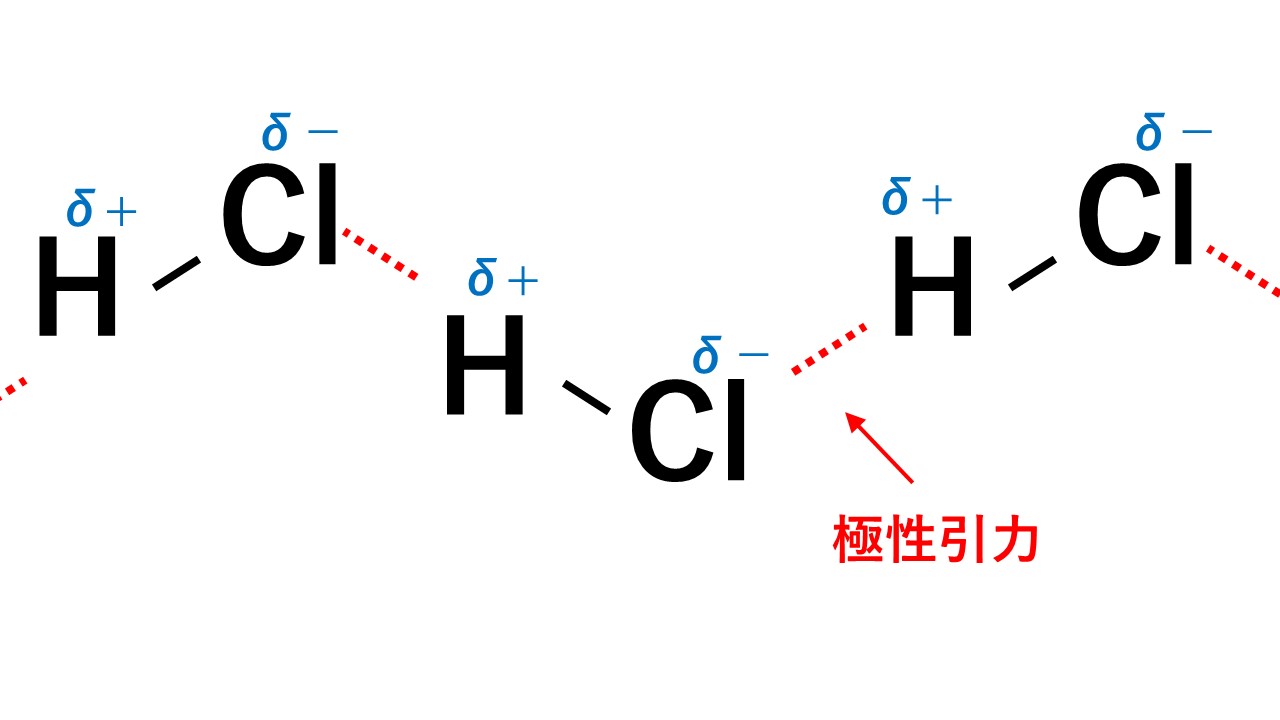
例えばHClの場合、Hがδ+,Clがδ-なので、一つのHCl分子中のH(δ+)と隣のHCl分子のCl(δ-)が引き付けあいます。
このようにして極性引力が生じます。
まとめ
灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師より、極性分子なのか、無極性分子なのかを自分で判断できるようになるための方法を図で詳しく解説しました。しっかりと覚えておきましょう。


