イオン化エネルギーとは、陽イオンにするときに必要なエネルギーのことです。周期表では右上が最大となる理由について具体的かつ丁寧に解説します。解説担当は、灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師です。
第一イオン化エネルギーとは
「原子から電子を一つ取り除いて一価の陽イオンになるときに必要なエネルギー」です。
そしてその大きさは周期表の「右上」が最大であり、「左下」が最小です。
「電子の引きつけ度合い」と理解しておくと、その理由がわかります。
それでは、細かく見ていきましょう。
イオン化エネルギーは電子の引きつけ度合い
イオン化エネルギーとは「原子から電子を一つ取り除いて一価の陽イオンになるときに必要なエネルギー」です。
そもそも原子核には陽子(+)が含まれているため、周りをまわっている電子(-)は原子核に引きつけられています。
電子を取り出し、陽イオンにするためには、その引力に負けないだけのエネルギーが必要となります。
つまり、原子核(+)が回りの電子を引き付ける引力が強いほど、陽イオンになるときにはたくさんのエネルギーが必要ということです。
イオン化エネルギーは周期表の右上が最大
周期
例えば、周期表の第2周期(Li~Ne)をもとに説明していきます。
第2周期の最外殻はすべてL殻で共通であり、真ん中の原子核内にある陽子(+)の個数が違います。
真ん中の原子核内にある陽子(+)が多いほど、回りの電子を引き付けやすいはずです。
つまり、周期表の右側の方が原子番号が大きく、陽子数が多いため、電子を引き付ける強さが強くなります。そのため、右側の方が電子を取り去るのに大きなエネルギーが必要となり、周期表の右側の方がイオン化エネルギーが大きくなります。
族
最外殻電子が原子核(+)に近い周期表の上側の方が電子を引き付けやすいはずです。つまり、周期表の上側の方が、最外殻までの距離が近いため、電子を引き付ける強さが強くなります。そのため、上側の方が電子を取り去るのに大きなエネルギーが必要となり、周期表の上側の方がイオン化エネルギーが大きいのです。
イオン化エネルギーは周期表の右上が最大
イオン化エネルギー最大の元素はHeです。
以下がイオン化エネルギーの大きさに関するグラフです。
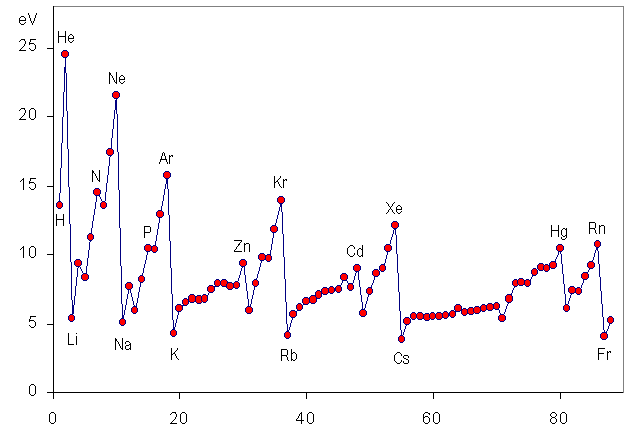
出典:https://ja.wikipedia.org/wiki/%E3%82%A4%E3%82%AA%E3%83%B3%E5%8C%96%E3%82%A8%E3%83%8D%E3%83%AB%E3%82%AE%E3%83%BC
まとめ
灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師よりイオン化エネルギーの定義と大小関係の解説を行いました。しっかりと覚えておきましょう。


