電気陰性度とは、つまるところ電子の引きつけ度合いのことです。共有結合の極性との関係性や、周期表での大小関係について具体的かつ丁寧に解説します。解説担当は、灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師です。
電気陰性度の定義と共有結合
電気陰性度とは共有電子対を各原子が引き寄せ,自らを電気的に陰性にしようとする強さの尺度のことです。
2つの原子がお互いに「不対電子」というものを出し合って「共有電子対」というペアになった電子をつくり、これを共有する事によってその2つの原子が結合することを共有結合といいます。(詳しくは共有結合に関する記事を後日執筆します。)

それぞれの原子が共有電子対を自分の方に引っ張る強さを電気陰性度といいます。
つまり、電気陰性度が大きい原子の方が共有電子対を自分側に引き寄せます。
電気陰性度と結合の極性
電気陰性度が大きい原子の方が共有電子対を自分側に引き寄せます。
この結果、分子内において、電気陰性度が大きい原子の方に電子が片寄ることとなり、電気的な偏りが生じることになります。この偏りが「結合の極性」の原因となります。
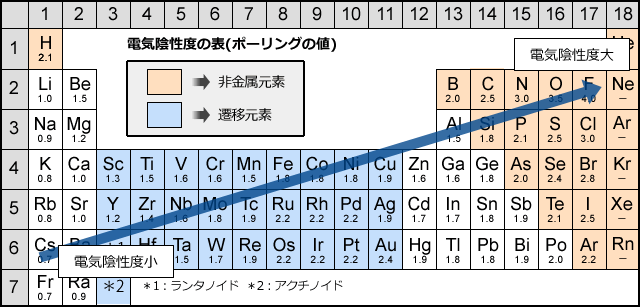
電気陰性度は周期表の右上が大きい
電気陰性度は電子を引き付ける力の強さなので、イオン化エネルギーや電子親和力のように、周期表の右上にいくほど大きく、左下に行くほど小さくなる傾向があります。
出典:http://blog.donaldo-plan.com/
希ガスは非常に安定的でそもそも他の原子と共有結合をしません。そのため、共有電子対を引き付ける力の強さである電気陰性度の定義がありません。
まとめ
灘・甲陽在籍生100名を超え、東大京大国公立医学部合格者を多数輩出する学習塾「スタディ・コラボ」の化学科講師より電気陰性度の定義と周期表での大小関係の解説を行いました。しっかりと覚えておきましょう。


